まず、科学史的な視点で温度の概念の変遷を見てみよう。
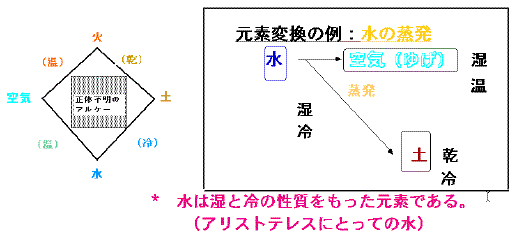 アリストテレスの四元素説
アリストテレスの四元素説古代ギリシャのアリストテレスは、温と冷は、水・空気・土・火の四元素がもつ性質であると言った。火で熱すれば温まり、水で冷やせば冷たくなるという感覚と結びついた理解が人々に受け入れやすかったのだろう。このアリストテレスの四元素説は、空気=気体、水=液体、土=固体という状態変化と、それを引き起こす火=熱エネルギーと対応させてみると、元素変換と状態変化の区別ができなかった時代の自然観として興味深い。18世紀には、熱の本体は熱素(カロリック)という微粒子と考えられていたことが、ラボアジェの単体表(1789)から分かる。また、原子論を復活させ(1803)近代化学の父と呼ばれたダルトンも熱を原子と考えていた。熱が力学的仕事(エネルギー)の一形態であることを明確に示したのはマイヤー(1842)である。一方、熱力学の基礎を築いたヘルムホルツは、熱力学第一法則(エネルギー保存則)によって熱とエネルギーと仕事との関係を明らかにした(1847)。
ボイル・シャルルの法則は、気体の膨張・圧縮の際なされる仕事(体積変化x圧力)と温度との関係を定式化したものである。
PV=nRT <Pは気体の圧力、Vは体積、nは物質の量、Rは気体定数、Tは絶対温度)
次式は、この法則と気体分子(粒子)の衝突論を基礎とする気体分子運動論とを結びつけたものである。
PV=(1/3) n・mv2 <nは分子の物質量、mは分子のモル質量、vは速度の二乗平均>
=(2/3)n・(mv2/2) = (2/3)n・E <Eは分子1モルの運動エネルギー>
すなわち、気体分子というミクロな粒子の運動エネルギーE(または二乗平均速度 v)と気体の体積または圧力変化というマクロな現象との関係が示したものとして重要である。この関係式から、気体分子の速度が速くなると、容器の壁への衝突数が増大し、その結果として圧力を増すと説明される。
また上式から
E=(3/2)RT
が導き出され、気体分子の運動エネルギーは温度に比例することが分かる。液体の場合は比例関係ではないが、Tが大きくなるに従ってEが大きくなるという関係がある。従って、気体でも液体でも温度を上げると分子の運動が激しくなり、それだけ分子の速度が速くなる。
なお、気体分子運動論の重要な結論であるマックスウエルの速度分布則(1860)を図示すると、
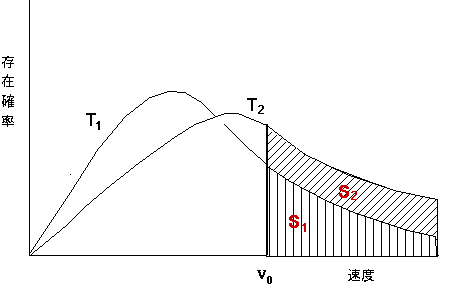 マックスウェルの速度分布
マックスウェルの速度分布すなわち、温度がT1→T2に上昇すると、速度(運動エネルギー)の大きな分子の存在確率が多くなり、それだけ分子間の衝突回数が増す。例えばv0以上の速度を持つ分子だけが化学反応すると仮定すると、図からそれぞれの存在確率はS2>S1となり、反応速度が温度に依存することが理解できる。速度の大きな分子同士の衝突の結果、原子間の結合の切断あるいは再結合(化学反応)の起こる。これが、温度を上げると反応が速くなることの理論的説明である。一般に、温度が10℃上がると反応速度は2倍になる。
現象 1:温度を上げると気体が膨張し、下げると収縮する。(ボイル・シャルルの法則:PV=nRT )
分子の速度が速くなると器壁への衝突回数が増して圧力が増加し、その結果、気体が膨張する。逆に、暖めた容器を蓋をしたまま冷やすと気体分子の速度が遅くなって収縮する。これらの関係は、簡単な実験事実(1. ビニール袋にアルコールを入れてヘアドライアーで暖めると膨らむ。2. アルミ缶に水を入れて沸騰させた後に冷水に逆さにつけるとつぶれる。)で確認できる。
現象 2:温度を高くすると化学反応速度が速くなる。
(マックスウェルの速度分布則)
温度を高くすると分子の速度が速くなり、分子同士の衝突回数も多くなる。また、大きな運動エネルギーをもって衝突するほど原子間の結合が切れる確率が高くなり、原子の再配列を引き起こす。すなわち、温度を高くすると化学反応速度が速くなる。簡単な化学実験(塩酸と炭酸ナトリウムを0℃、15℃、30℃、60℃の温度条件で同時に反応させ発生するCO2の量を風船を膨らませる速さで観察する。)で確認する。
現象 3:温度を変えると状態変化が起こる。
水の状態変化はよく知れていることであるが、水の三態変化を例にして(実際に加熱により氷→水→水蒸気への変化する過程を温度を測りながら観察する。)、分子の熱運動エネルギー(E)と分子間引力(A)の釣り合いによって決まることを示す。ここで、水分子間の引力は不変であるから、熱エネルギーによって状態変化が起こることを示す。固体:E<A, 液体:E≒A, 気体:E>>A熱エネルギーが小さい場合に起こるのは状態変化だけで原子間の結合が切れることはない。